お知らせ
エーザイのアルツハイマー病治療薬レカネマブ:内藤CEO、米国でのフル承認に「圧倒的な自信」─国内での承認時期は「遅くとも9月」【Breakthrough 医薬品研究開発の舞台裏】
エーザイの内藤晴夫代表執行役CEOは3月9日に開いた記者会見で、日本・米国・欧州での「2023年中のフル承認」を目指しているアルツハイマー病治療薬レカネマブ(米国ブランド名:レケンビ)について最新の審査状況などを説明した。7月6日までに可否の判断が出るとみられている米国でのフル承認について内藤CEOは「圧倒的な自信を持っている」と強調。国内での承認時期については担当役員が「遅くとも9月」との見通しを示した。課題となっている日本での価格設定や早期AD診断の体制整備を含め、記者会見で示されたエーザイの見通し・考え方を詳報する。
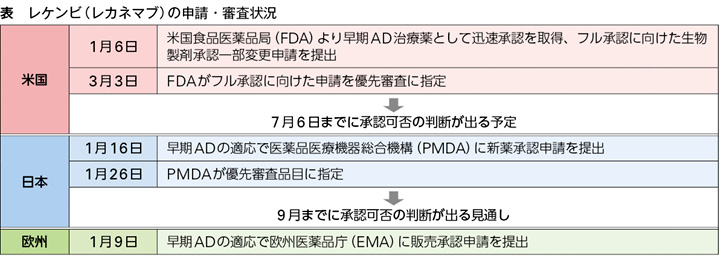
レカネマブは、アミロイドβの脳内異常蓄積がアルツハイマー病(AD)の原因の1つとする「アミロイドβ仮説」に沿って、エーザイが米バイオジェンと共同開発したAD疾患修飾薬。脳内に蓄積したアミロイドβプラークの減少効果を示した臨床第2相試験に基づき、今年1月6日に米国食品医薬品局(FDA)より早期AD治療薬として「迅速承認」を取得している。

エーザイは迅速承認取得と同時に、レカネマブがプラセボに対して27%の悪化抑制を示すことなどを確認したグローバル臨床第3相検証試験(Clarity AD)のデータを用いて、フル承認への変更を求める申請をFDAに提出。日本の医薬品医療機器総合機構(PMDA)には1月16日に承認申請を行った。
米国のFDAは3月3日、フル承認に向けたエーザイの申請を優先審査に指定し、審査終了目標日を7月6日に設定した。日本のPMDAも1月26日にレカネマブを優先審査品目に指定した。
9日の記者会見で内藤CEOは、米国でのフル承認について「(Clarity ADのデータは)ほぼ完璧なデータ。インパクト度の高いジャーナル(=NEJM)で公表されており、圧倒的な自信を持っている」と述べた。
日本での審査状況については中濱明子執行役が説明し、「非常にスムーズに審査が進んでいる。承認時期は遅くとも9月」と、9月よりも早く承認される可能性もあることを示唆した。

「社会的インパクト評価した薬価算定を」
米国での価格設定に当たりエーザイは、「質調整生存年(QALY)の増加分」などから早期AD当事者1人当たりのレケンビ(レカネマブ)の年間社会的価値を3万7600ドルと推定。その上で、米国での発売価格(年間卸業社購入価格)を2万6500ドルとした。
会見で内藤CEOは、日本でのレカネマブの価格設定について「米国での価格設定と同じモデルで考察を進めており、5月には論文化する。革新的医薬品の薬価算定は、社会的インパクトを評価することにより行われるべきというのが我々の考えで、Value-based Pricingを導入してほしいと思っている。その方式がイノベーションを牽引し、製薬産業の閉塞感を打破する」と述べ、AD進行の抑制による医療費・介護費削減効果を反映した薬価を求める考えを示した。
PET・CSF診断の保険収載に期待
レカネマブがこのまま国内で承認された場合、適応症は「脳内アミロイド病理が確認されたADによる軽度認知障害(MCI)および軽度認知症」となる。レカネマブを使用するには、アミロイドPET検査や脳脊髄液(CSF)検査でアミロイドβの蓄積を確認する必要があり、こうした早期AD診断の体制整備も課題となっている。エーザイによると、アミロイドPET診断が可能な施設は現在全国に約51施設あるという。
会見で内藤CEOは「アミロイドPET・CSF診断のキャパシティは十分にある。レケンビ(レカネマブ)承認のタイミングに合わせて、PET・CSF診断の保険収載が大いに進むと期待している」と述べ、レカネマブ上市時にPET・CSF診断も保険収載される可能性があるとの見方を示した。
内藤CEOはまた、アミロイドβ蓄積のスクリーニングに使用されている島津製作所やシスメックスの血液バイオマーカーも、実臨床でのエビデンスの蓄積により「近い将来、アミロイドβ確定診断に活用される可能性が高まっている」とし、2025年までに確定診断に用いられる状況となることに期待感を示した。
投与対象者は早期AD有病者の「1%」
エーザイは、2025年の日本の早期AD有病者数を600万人と推計。レカネマブなどのAD疾患修飾薬投与に至るには①当事者が医療機関を受診し早期ADと診断、②アミロイドβ検査を受け、陽性と判定─といったハードルを越える必要があるため、600万人のうち実際に投与対象者となるのは1%程度(約6万人)と見積もっている。
一方、グローバルの推計では2032年に早期AD有病者数は2.4億人、AD疾患修飾薬投与対象者数は約300万人に上ると予測。内藤CEOはこうしたシミュレーションをもとに、レケンビの売上収益は2030年度には「グローバルで1兆円レベル」に達するとの見通しを示した。
イーライリリーのドナネマブなど他社のAD治療薬開発も急ピッチで進められている。内藤CEOは認知症領域においては「圧倒的に、ぶっちぎりでトップランナーとして走りたい」と述べ、レカネマブ開発で得た「創薬成功パターン」を踏襲して抗タウ抗体などのAD治療薬開発も加速させていく考えを示した。

【関連記事】
エーザイ、日本でもAD疾患修飾薬レカネマブの承認申請─「早期AD」の適応を希望
AD治療薬レカネマブ、米FDAより迅速承認取得─「年間2万6500ドル」と価格設定
エーザイ:AD疾患修飾薬レカネマブ、日米欧で2022年度中に承認申請へ














































