お知らせ
【一週一話】骨と感覚神経
骨の恒常性は,骨をつくる細胞(骨芽細胞)による骨形成と,骨を吸収する細胞(破骨細胞)による骨吸収とのバランス(骨代謝)により保たれている。
近年の高齢化社会の進展により,骨粗鬆症患者が急増している。骨粗鬆症に対する有効な治療薬の開発には,骨代謝のメカニズムを様々な視点から研究し,骨恒常性の維持機構を解明することが不可欠である。
骨形成と骨吸収のバランスは様々なホルモンやサイトカインなどで制御されているが,近年,神経系による骨代謝調節が注目されている。これまでの様々な研究により,交感神経系や副交感神経系による骨代謝制御が知られていたが,最近,筆者らは感覚神経系が骨代謝に影響することを見出した。
本稿では,感覚神経による骨代謝調節について概説したい。

セマフォリン3Aと骨代謝調節
セマフォリン3A(Semaphorin 3A;Sema 3A)は化学忌避物質として知られるセマフォリンファミリーに属し,胚発生において神経軸索の伸長の方向性を決める重要な因子として知られている1)。全身のあらゆる臓器から分泌されるSema3Aを欠損したマウス,すなわちSema3A欠損マウスでは骨量の低下が認められたことから,Sema3Aが骨代謝調節に関係するものと考えられていたが,その詳しいメカニズムは不明であった2)。
筆者らは,神経から分泌されるSema3Aに着目し,その骨代謝に及ぼす影響を検討した。まず,神経から分泌されるSema3Aのみを欠損したマウスを作製した。このマウスの骨組織を解析したところ,全身でSema3Aを欠損したマウスと同様に骨形成が低下し,骨量が減少していた(図1)。したがって,神経から分泌されたSema3Aこそが全身の骨代謝を調節する因子であることが明らかになった。
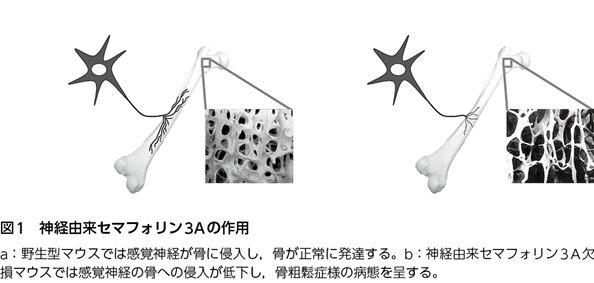
セマフォリン3Aによる骨内感覚神経形成の制御
Sema3Aは神経細胞から分泌され,軸索形成を制御することが知られている。そこで,Sema3Aの変異マウスにおける骨での神経の形成について検討した。すると,全身でSema3Aを欠損したマウス,および神経から分泌されるSema3Aのみを欠損したマウスの骨組織において,感覚神経線維の形成の低下が認められた。一方,骨代謝に対して抑制的に作用し,骨量を減少させることが知られている交感神経系線維の形成に変化は見られなかった。
また,神経特異的Sema3A欠損マウスにおける実際の感覚について調べたところ,触痛覚,温覚,圧覚のすべてにおいて閾値の低下が認められた。これらの結果から,神経から分泌されるSema3Aのみを欠損したマウスでは,感覚神経の骨への侵入が低下し,感覚機能にも異常があることが明らかとなった。
感覚神経と骨代謝
辛み成分の1つであるカプサイシンを大量に投与すると,感覚神経が破壊されることが知られている。そこで,野生型のマウスにカプサイシンを投与し,骨組織を観察したところ,骨内の感覚神経の形成が低下し骨量が減少していた。一方で,神経から分泌されるSema3Aのみを欠損したマウスでは,カプサイシンを投与しても,さらなる感覚神経の侵入の低下や骨量の減少は認められなかった。したがって,骨における感覚神経線維の形成および侵入の低下が骨量減少の誘因となることが明らかとなった。
さらに,骨再生時におけるSema3Aの役割を検討したところ,神経から分泌されるSema3Aのみを欠損したマウスでは,骨再生能力が大きく低下しており,この際,新生骨への感覚神経の侵入の低下を伴うことが観察された。これら一連の結果によって,骨内の感覚神経が単に感覚受容器として働いているだけでなく,骨量調節の機能も有するという,新たな骨代謝制御系の存在が明らかとなった3)。
◉
これまで,ヒトにおいても,自律神経や感覚神経の低下を伴う家族性自律神経異常症(familial dysautonomia)の患者では,骨粗鬆症の頻度が高く,易骨折性が見られることが知られていたが,その原因は不明であった4)。今回の結果から,ヒトにおいても感覚神経系の骨への侵入が骨代謝の維持に重要であることが示唆された。
今後,骨粗鬆症の新規治療法の開発において,感覚神経は新たなターゲットになりうる可能性を秘めていると言えよう。
文 献
1)Kruger RP, et al:Nat Rev Mol Cell Biol. 2005;6(10):789-800.
2)Hayashi M,et al:Nature. 2012;485(7396) :69-74.
3)Fukuda T,et al:Nature. 2013;497(7450): 490-3.
4)Maayan C, et al:Osteoporos Int. 2002;13 (5):429-33.





































