お知らせ
痛みの抑制理論「ゲートコントロール説」の現代的意義は?
“GATE Control Theory”は現代ではどのように考えられているのでしょうか(新しい発見・研究や試みはありますか)。神経生理学の立場からのご解説をお願いします。
(質問者:愛媛県 T)
【回答】
ゲートコントロール説(図1)は,MelzackとWallが1965年にScience誌に発表した痛みの制御に関する学説です1)。それから50年経った今,その学説が再び学術誌を賑わせています。ここ数年,脊髄後角神経回路について複数の論文が報告され,ゲートを形づくる神経回路の実体がしだいに明らかとなってきました。最新の報告においても,その結果は図1をモデルとして図式化されています。これはゲートコントロール説が,50年を経た現在もなお色褪せない学説であることを示しているのではないでしょうか。また,この学説で重要なのは,脊髄に設定したゲートだけではなく,そのゲートが中枢からの調節を受けることでもあります。それらについて,最近の知見を紹介したいと思います。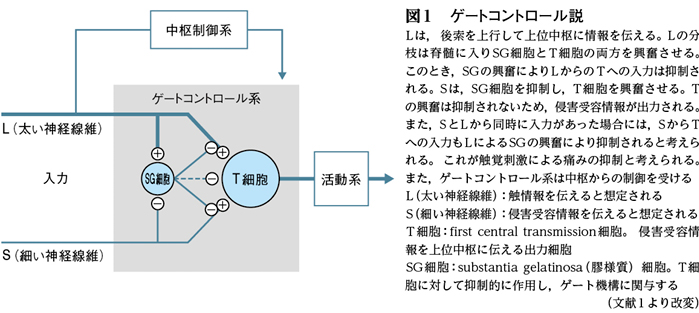
まず,神経回路の研究が進んだ背景として,脊髄後角神経細胞の分類が進んだことが挙げられます2。図1のSG(substantia gelatinosa)とは膠様質と呼ばれる脊髄後角の第Ⅱ層で,この説ではその抑制機能が重要です。図では1種類の抑制性介在ニューロンがあるように描かれていますが,膠様質の介在ニューロンは30%が抑制性で,70%が興奮性であることが知られています。また,これらの細胞は機能的(興奮性・抑制性)に異なるだけではなく,さらに形態や発現している分子によって,より多くのグループに分類されることがわかってきました。
その分類をもとに,細胞と細胞の神経連絡を調べる研究が行われました。また,この数年の報告では最新の遺伝学的手法が駆使され,各グループの細胞を特異的に脱落させたり,興奮性をコントロールしたりできるような遺伝子改変マウスが作製され,各細胞のゲート中の役割が推測できるようになりました3)~5)。これらの知見によって得られた結果を図2にまとめています。今回は,これら各種の細胞1つひとつについて説明することは省略しますが,非常に複雑な神経回路網が構築されていることがおわかり頂けると思います。ただ,神経連絡が予想されるものの,すべてについて機能的実証があるわけではありません。図1のSG細胞の役割は,これらの神経細胞からなる神経回路の実質活動の総和と考えられます。また,一次求心性線維からの入力はすべて興奮性であるため,図1の細い神経線維からSG細胞への抑制性入力は,介在ニューロンを介していると解釈することができます。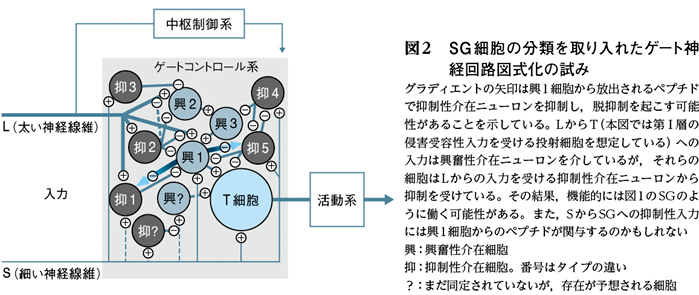
中枢からのコントロールについては,セロトニン(5-HT)やノルアドレナリン(NA)に対するⅡ層介在ニューロンの応答が調べられています。細胞を分類して,5-HTやNAに対する応答を比較すると,興奮性介在ニューロンでは抑制反応,抑制性介在ニューロンでは興奮反応が観察される傾向があるとする報告があります。また,脳幹刺激により単シナプス性のGABAやグリシンの入力があることも示されています6)。これらの下行性線維を刺激することで,ゲートでの興奮性と抑制性のバランスが後者に傾く,すなわちゲートを閉じる方向へ傾くと考えられています。
臨床で行われている経皮的電気神経刺激(transcutaneous electrical nerve stimulation:TENS)や脊髄刺激療法(spinal cord stimulation:SCS),脳深部刺激療法(deep brain stimulation:DBS)等の効果は,ゲートコントロール説により説明されています。ここで紹介した知見はそれらをよくサポートすると同時に,新たな治療法開発へと発展する可能性もあります。現在の刺激療法はゲートの外から刺激を行いますが,ゲート内で特定の細胞に対して活動を選択的にコントロールすることができれば,よりよい鎮痛効果が得られるかもしれません。多くの研究が必要ですが,介在ニューロン刺激療法が可能となるかもしれません。
【文献】
1) Melzack R, et al:Science. 1965;150(3699):971-9.
2) Todd AJ:Nat Rev Neurosci. 2010;11(12):823-36.
3) Duan B, et al:Cell. 2014;159(6):1417-32.
4) Yasaka T, et al:Mol Pain. 2014;10(1):3.
5) Petitjean H, et al:Cell Reports. 2015;13(6):1246-57.
6) Kato G, et al:J Neurosci. 2006;26(6):1787-94.
【回答者】
八坂敏一 鹿児島大学大学院医歯学総合研究科 感染防御学講座免疫学分野准教授





































