お知らせ
新型コロナに対する遺伝子ワクチンの最新の知見と新規変異ウイルスに対する効果[J-CLEAR通信(124)]

新型コロナ感染症が発生してから約1年が経過した。感染者数,死者数は増加の一途をたどり,2021年1月29日現在,新型コロナPCR確定総感染者数は世界全体で1億人を超過し,総死者数は218万人に達する(粗死亡率:2.2%)。不顕性感染者を含む総感染者数はPCR陽性者数の約10倍と考えられるので1),現時点での世界総感染者数(推定)は約11億人(世界総人口の約15%)である。感染が世界で最も深刻な米国においては,1月29日現在,PCR確定総感染者数が2535万人,総死者数が42万6000人に達する(粗死亡率:1.7%)。2020年12月中旬には米国における総死者数が第二次世界大戦(1941~1945年)における米国の総戦死者数(約29万人)を超過し,今回の新型コロナ感染症の危機的状況は第二次世界大戦を上回るものであることを示している。このままでは新型コロナによって人類は破滅に陥る可能性があり,それを阻止するためにはワクチンによる感染予防・制御が絶対的に必要である。
2月2日現在,95種類のワクチンが開発途上にあり,10種類のワクチンが各国で緊急使用を含む使用承認を受けている(表1)。さらに,第3相試験中のワクチンが20種類,第2相試験中のものが25種類,第1相試験中のものが36種類存在する。開発が中止されたワクチンは4種類にのぼる。以上のワクチンのうち,3種類の遺伝子ワクチンに関する大規模第3相試験が終了した(Pfizer社とBioNTech社のBNT162b2,Moderna社のmRNA-1273,AstraZeneca社のChAdOx1)。これらの3種類の遺伝子ワクチンは,2021年の2月中旬以降に本邦にも導入される予定であり,それらの基礎的・臨床的特徴を把握しておくことは,2021年における新型コロナ感染症に対する本邦での抜本的対策を構築する上で重要である。

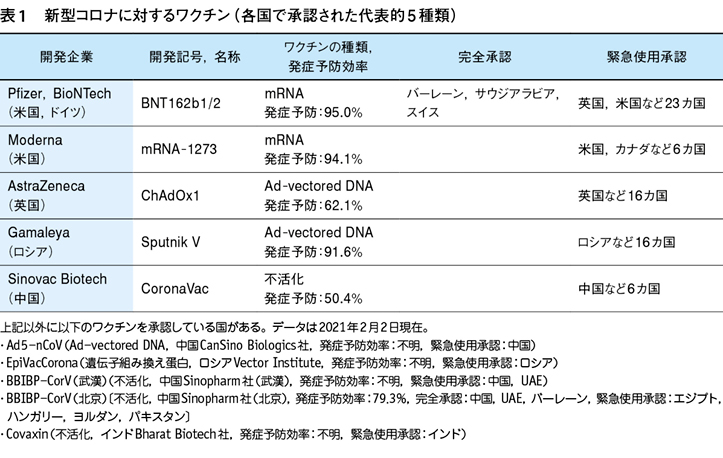
しかしながら,昨年の11月以降,英国,南アフリカ,ブラジルで流行しはじめた新たな変異株(N501Y株)は現在のワクチンに対して抵抗性を有すことが示唆され,N501Y株が世界を席巻するようになると現在のワクチン政策を根本的に見直す必要が出てくる。本稿では,第3相試験を終了した3つの遺伝子ワクチンの特徴を整理するとともにN501Y株に対する効果について考察する。
1 3種の先行遺伝子ワクチンの特徴(表2)
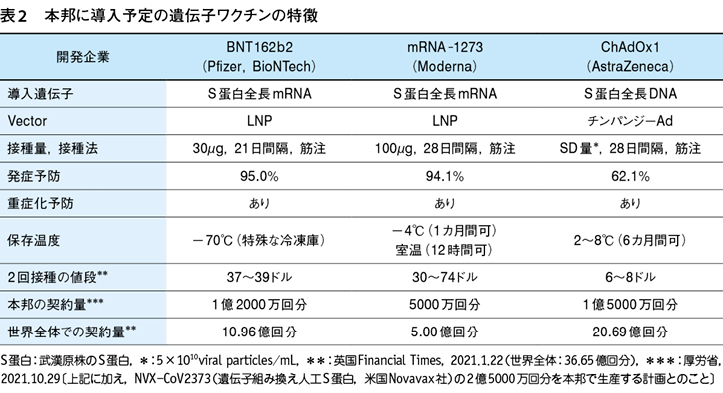
(1)Pfizer社・BioNTech社のBNT162b2
Pfizer社とBioNTech社のRNAワクチンBNT162b2に関する第3相試験の結果2)を受け,2020年12月2日に英国,12月11日に米国においてBNT162b2の緊急使用が承認され,医療従事者,高齢者,施設入居者などを対象としてワクチン接種が開始されている。2021年2月2日現在,本ワクチンは3カ国で完全使用,23カ国(EUを含む)で緊急使用の認可を受けている(表1)。2020年12月18日,Pfizer社は本邦へのワクチン導入をめざし厚労省に製造承認を申請した(2021年2月14日特例承認)。
BNT162b2は新型コロナウイルス感染にあって最も重要なS蛋白の全長に関する遺伝子情報(塩基配列)を脂質ナノ粒子(lipid nanoparticle:LNP)に封入し宿主細胞に導入したものである。この場合,S蛋白として2019年末に武漢で発生した武漢原株由来のものを用いている。BNT162b2はRNAワクチンの中で最も抗体産生効率がよいと考えられている(必要な1回ワクチン量は30μgと最も少ない)。LNPは後述するアデノウイルス(Ad)を輸送媒体(ベクター)とするDNAワクチンと異なり抗原性を有さず,生体はLNPに対する特異抗体を産生しない。また,細胞核に取り込まれる必要がないためS蛋白に対する遺伝子情報を有するRNAの宿主細胞への移行率は高く,投与したRNAの95%が宿主細胞に取り込まれる。さらに,LNPはadjuvant作用を有し生体のS蛋白に対する抗体産生能を高める。本ワクチンの問題点の1つは,-70℃±10℃という低温で保存しないとワクチンの安定性を維持できないことである。
BNT162b2の第3相試験は,16歳以上の若年者から高齢者までを対象として米国,アルゼンチン,ブラジル,南アフリカ,ドイツ,トルコの6カ国で施行された(n=43548)。中間総括では,2回目のワクチン接種(1回目接種後21日の間隔をあけて接種)後7日目以降最大で3カ月におけるコロナ発症予防有効性を報告している。ワクチンの有効性は95.0%であり,人種・民族,性差,年齢,併存症による影響を認めなかった。重症化した症例が10例存在したが,対照群で9名,ワクチン接種群で1名であり,ワクチンは重症化阻止効果を有することが示唆された。副反応・有害事象の内容・頻度は他のワクチン接種時にも認められる一般的なものであり,特に問題となるものは存在しなかった。本第3相試験では15歳以下の若年者・小児,妊婦,免疫不全を有する患者は除外されており,これらの対象におけるワクチンの効果,あるいは,有害事象については今後の検討課題である。
ワクチンの有効性が,最長でも2回目のワクチン接種後3カ月で判定されており,ワクチンを年間何回接種する必要があるかを決定するためには,より長期にわたる液性・細胞性免疫の動態観察が必要である。もう一点注意すべき事項はワクチン有効性の判定基準である。新規感染はコロナを疑わせる臨床症状の発現(有症状)に加え呼吸器検体におけるPCR陽性をもって定義された。すなわち,無症候性症例は有効性の判定から除外されている。PCR陽性者のうち無症候性感染者は約30%と報告されており3),市中におけるウイルス播種を考えるとき,無症候性感染に対するワクチン予防効果の検討が必要である。
ワクチン接種開始後のアナフィラキシー発生頻度が,190万人が1回目のワクチン接種を終了した時点で米国疾病予防管理センター(CDC)から報告された4)。アナフィラキシーを発症したのは21例で相対頻度は1.1/10万人,発症までの時間は接種後13分(中央値),女性が90%を占めた。81%の症例で何らかのアレルギーの既往(薬物,食物,昆虫,他のワクチン)を認めたが,19%は過去に何らのアレルギーの既往も有さなかった。Castellsら5)はアナフィラキシーの原因として,ワクチンに含まれるLNP安定剤PEG(polyethylene glycol)に対するアレルギー反応の可能性を示唆した。PEGは浸透圧性下剤で大腸内視鏡時に汎用される物質である。以上のような点を鑑み,米国CDCはPfizer社のBNT162b2ならびにModerna社のmRNA-1273接種において,PEG製剤に対してアレルギーの既往を有する人を接種対象から除外した6)。しかしながら,食物(卵を含む),ゴム,ラッテクス,ゼラチン,ペット,毒物,環境アレルゲン,薬物に対するアレルギーはワクチン接種の禁忌ではないとした。一方,英国保健省は従来のワクチン,食物,薬物などに対するアレルギーの既往を有する人をRNAワクチン接種対象から除外した5)。















































