お知らせ
【Breakthrough 医薬品研究開発の舞台裏(10)横田祥士(沢井製薬 常務執行役員/研究開発本部長)】「他社に先んじて一番に上市」目指し高付加価値のジェネリック医薬品を開発

後発医薬品使用割合80%目標の達成時期が2020年9月に迫り、「ポスト80%時代」も見据えた開発戦略が求められるジェネリック医薬品メーカー。先発医薬品と同等以上の品質を持つ「高付加価値ジェネリック医薬品」の開発を追求し業界を牽引する沢井製薬は、具体的にどのように研究開発を進め、他社製品との差別化を図っているのか。研究開発本部長の横田祥士さんに、選択的NK1受容体拮抗型制吐剤「アプレピタントカプセル「サワイ」」など最近上市した新製品での製剤工夫の事例を紹介してもらいながら、同社の研究開発の基本戦略、さらなる競争激化が予想される「ポスト80%時代」の課題を聞いた。


よこた しょうじ:東大薬学部卒。薬剤師。薬学博士。山之内製薬、アステラス製薬(技術本部・執行役員)を経て、2018年6月より沢井製薬研究開発本部長。
経口製剤でナノ化を実現
─沢井製薬では最近の製品開発でどのような工夫をしているのか、具体的な事例をご紹介いただけますか。
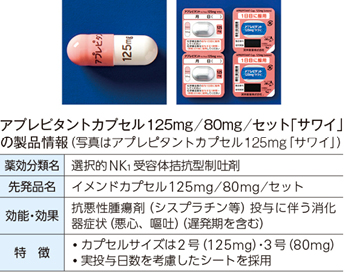
横田 2019年12月に上市したばかりの新製品ですが、選択的NK1受容体拮抗型制吐剤「イメンド」の後発品として初めて承認された「アプレピタントカプセル「サワイ」」という製品では、原薬をナノ粒子まで小さくする技術を用いました。ジェネリックの経口製剤でナノ化したものはこれまでになく、世の中に最初に出せたことは非常に意義があると思っています。
実は、アプレピタントは粒子の規格と添加剤に関して先発品メーカーの特許があり、これらを回避できるかが課題でした。添加剤は使わなければならなかったのですが、粒子の規格については特許回避できるだろうということで異なる粒子サイズで製剤化しました。
粒子サイズが異なると吸収などが変わる可能性がありますので、まずイヌで生物学的同等性の予備検討を行い、ヒトでも同等性が確保できることを予測してから生物学的同等性試験を実施しました。生物学的同等性試験は健常人を対象としますので、私たちはできる限り動物で根拠をつくることを大切にしています。
─アプレピタントは、抗がん剤投与に伴う悪心・嘔吐などの症状を抑える薬ですね。
横田 患者さんは悪心などがある状態で服用する可能性があるのでカプセルサイズも小さいほうがいいだろうと考え、2号カプセル(全長17.8mm)と3号カプセル(全長15.8mm)を採用しました。
─ほかに開発に苦労したものはありますか。
横田 アプレピタントカプセルと同時に薬価収載されたキャンディン系抗真菌剤「ミカファンギンNa点滴静注用「サワイ」」(先発品:ファンガード)は凍結乾燥品ということで、先発品の特許を回避しながら安定化を図るのに苦労しました。ガラス製バイアルであることから、底部にオリジナルのプロテクターを付けて破瓶を防止し、使い勝手を良くしたのも工夫した点です。
特許戦略やin vitro試験を重視
─沢井製薬の研究開発の基本戦略を教えてください。
横田 「なによりも患者さんのために」という企業理念がどの部門でも重要な視点となりますので、研究開発本部でも患者さんの視点に立った製品開発を一番大事にしています。数あるジェネリックメーカーの中から沢井製薬の製品を選んでいただくために、他社とは違う製品を開発することを使命とし、「他社に先んじて一番に上市すること」を第一に考えています。
─第一にスピードを大切にしていると。
横田 激しい競争の中で一番に上市することで市場も確保でき、多くの患者さんに喜んでいただくことができます。一番に上市するためにまず大事なのは特許戦略です。原薬の特許、製剤の特許など先発品の特許を侵害しないように回避しながら、同等性も担保しつつ、いかに他社とは異なる特徴を有する製品を開発するかが大きな課題になっています。
特に重要なのが原薬の選定です。先発品と同等以上の品質を目指して世界中に資源を求め、良質の原薬を調達し製品化に結びつけていくのが私たちの戦略です。
早く製品を開発することにもつながる話ですが、被験者のリスクを減らすために、私たちは生物学的同等性試験を実施する前にin vitro試験でin vivoを予測し、成功確率を十分に上げてから生物学的同等性試験に入るという戦略もとっています。
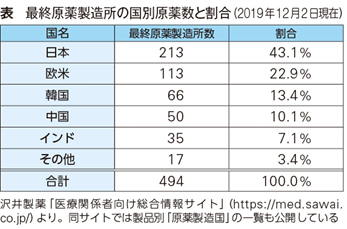
─原薬に関しては、原薬製造国の情報公開にも積極的に取り組んでいますね。
横田 昨年7月からウェブサイトで情報公開を始めました(表参照)。最終原薬製造所だけでなく、前段階の粗原薬製造所の国名まで開示しています。今後もできる限り広く情報提供していきたいと考えています。
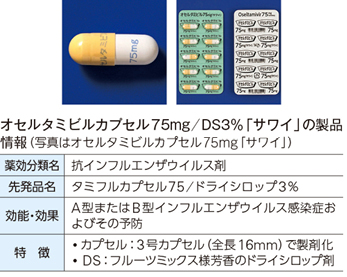
─他社に先んじてジェネリックを出すということではインフルエンザ治療薬オセルタミビル(先発品:タミフル)のジェネリックもどこよりも早く開発しました。他社が出せない製品をつくれる秘訣は何ですか。
横田 オセルタミビルに関しては原薬の調達ができたことが大きいと思います。当社は多くの原薬メーカーとお付き合いしながら良質の原薬を選定していきますので、その選び方がなかなか他社ではまねのできない選び方だったのではないでしょうか。
新規領域への進出や海外展開も視野
─さらなる競争の激化が予想される「ポスト80%時代」の戦略についてはどのように考えていますか。
横田 ポスト80%時代になっても、信頼されるジェネリックをいち早く開発するという基本スタンスは変わりません。技術力で他社が出せない製品を出すことが第一の使命ですが、その上で、新しい領域に活動の範囲を広げていくことも当然必要だと考えています。
─日本ジェネリック製薬協会が昨年発表した「次世代産業ビジョン」では、ジェネリックメーカーの今後の役割として「未病のケアと予防」などが示されています。
横田 「予防」から派生するビジネスエリアは視野に入っています。あらゆる可能性を検討し、進むべき方向を定めていきたいと考えています。
ポスト80%時代を見据えて国内だけでなく米国市場での可能性も追求したいということで当社は2017年にアップシャー・スミス・ラボラトリーズ社という米国のジェネリックメーカーを買収しました。ここをベースに海外展開を進めていくことも選択肢です。
─最後に現場の臨床医へのメッセージを。
横田 先発品メーカーが独占販売する十数年の間に科学は進歩し臨床現場のニーズも変化します。そうした情報を把握し付加価値を付けて製品化するのがジェネリックメーカーの使命と考えています。ぜひ付加価値をご理解いただき、私たちは先生方に選ばれる高付加価値の製品を今後も追求していきたいと思います。














































