お知らせ
マッキューン・オルブライト症候群の原因

【Q】
小児慢性特定疾病に指定されているマッキューン・オルブライト症候群(McCune-Albright syn-drome:MAS)の原因となるGNAS1変異のメカニズムについて,ご教示下さい。
(東京都 F)
【A】
MASは,線維性骨異形成・皮膚カフェオレ斑・ゴナドトロピン非依存性思春期早発症を3主徴とする疾患群です。この3主徴がすべてそろわないこともあります。Ringelら(文献1)の報告では,MAS患者のうち線維性骨異形成は98%,皮膚カフェオレ斑は85%,思春期早発症は52%に認められました。
線維性骨異形成は,変形を伴う骨変化であり,時に病的骨折の原因となります。思春期早発症以外の内分泌機能異常として,下垂体性巨人症,甲状腺機能亢進症,Cushing症候群,低リン血症性くる病などが報告されています。
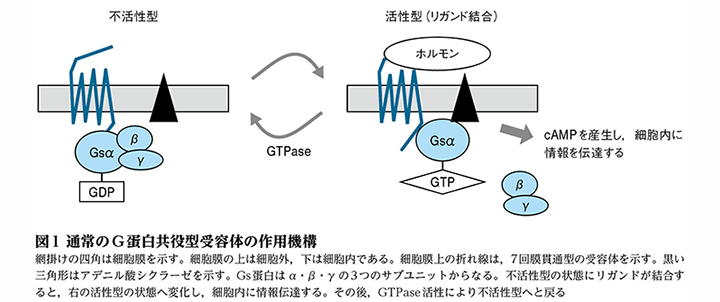
MASの原因遺伝子であるGNAS1遺伝子は,20番染色体長腕の13.2~13.3領域に存在し(文献2),Gsα蛋白をコードしています。Gsα蛋白は,G蛋白共役型受容体の細胞内情報伝達に重要な役割を担っています(図1)。
Gsα蛋白は,ホルモンが7回膜貫通型のG蛋白共役型受容体に結合すると,結合していたGDPを遊離して,代わりにGTPを結合します。GTPが結合したGsα蛋白がアデニル酸シクラーゼを活性化することでcAMPが産生され,細胞内に情報が伝達されます。情報伝達後,Gsα蛋白は,自らが持つGTPase活性によりGTPをGDPに変化させることで活性を制御しています。
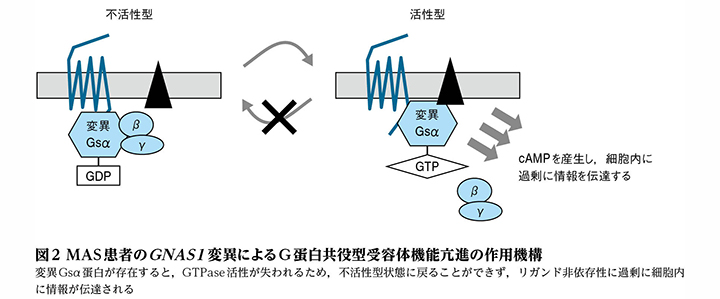
MASの原因は,GNAS1遺伝子の体細胞性変異によるリガンド非依存性の受容体機能亢進です。以下に,MAS患者のGNAS1変異による受容体機能亢進および体細胞性変異という2つの特徴について概説します。
第一に,MAS患者のGNAS1変異による受容体機能亢進の特徴について,図2を用いて述べます。GNAS1変異は,Weinsteinら(文献3) ,Schwindingerら(文献4) によって報告された,201番目のアルギニンがヒスチジンまたはシステインに変化する変異です。この変異はGTPase活性を消失させ,リガンド非依存性にアデニル酸シクラーゼを持続的に活性化させ(文献5) ,細胞内cAMPを増加させます。その結果として,G蛋白共役型受容体である多くのホルモン受容体が過剰に活性化します。様々な内分泌疾患の原因は,Gsαを介する末梢内分泌腺の増殖と分泌です。
第二に,体細胞性変異について述べます。発生段階で変異が生じて,変異細胞が骨・皮膚・内分泌組織を含む全身にモザイク状に分布することにより,MAS患者の重症度が左右され,臨床症状の多様性が生み出されます。そのため,MASは必ず孤発例であり,MAS患者の体内でも,それぞれの内分泌器官や組織によって変異の割合が異なっています。
従来,リンパ球を用いたPCR直接シークエンス法による遺伝子診断は困難でした。リンパ球における変異細胞の割合は1%以下(いわゆる低頻度モザイク)であったからです。そのような中,Narumiら(文献6)は,次世代シーケンサーを用いて,リンパ球からMAS患者の75%に変異を同定することに成功しました。この新しい遺伝子診断法により,線維性骨異形成単独の症例などからもGNAS1遺伝子の変異が同定されれば,今後“Gsαリガンド非依存性機能亢進病”と呼ぶべき疾患単位が確立されるかもしれません。
【文献】
1) Ringel MD, et al:Medicine(Baltimore). 1996;75(4):171-84.
2) Levine MA, et al:Genomics. 1991;11(2):478-9.
3) Weinstein LS, et al:N Engl J Med. 1991;325
(24):1688-95.
4) Schwindinger WF, et al:Proc Natl Acad Sci U S A. 1992;89(11):5152-6.
5) Kahn RA, et al:J Biol Chem. 1984;259(10):6235-40.
6) Narumi S, et al:PLoS One. 2013;8(3):e60525.