お知らせ
原発性硬化性胆管炎/炎症性腸疾患への臨床活用:Klebsiella pneumoniaeの関与と治療応用の可能性[最新論文で学ぶ 腸内細菌叢の臨床活用(5)]
今回注目する論文
Nakamoto N, et al:Gut pathobionts underlie intestinal barrier dysfunction and liver Th17 immune responses in primary sclerosing cholangitis. Nat Microbiol. 2019;4(3):492-503.
原発性硬化性胆管炎(PSC)は,肝臓内外に存在する胆管に炎症が起こり数年から数十年の経過で肝硬変に至る難治性疾患であり,肝移植以外に有効な治療法がない。本疾患は炎症性腸疾患を高率に合併することから,病態への腸管炎症や腸内細菌の関与が示唆されてきたが,その詳細は明らかにされていなかった。本研究において,病態への腸内細菌の直接的な関連性を明らかにするために,患者から提供された糞便微生物サンプルを無菌マウスに投与し,患者の腸内環境を再現した「ヒトフローラ化マウス」を用いた検討が行われた。その結果,PSC患者の便中に,肝臓内のTh17細胞の活性化を引き起こす3種類の腸内細菌が高確率で存在することを見出した。この中の1つであるKlebsiella pneumoniaeは大腸の上皮に穴を開け腸管バリアを破壊し,腸管の外にあるリンパ節に移行し肝臓内の免疫応答を誘導することが示された。さらに,抗菌薬によるK. pneumoniaeの排除により,肝臓内に誘導されたTh17細胞が著明に減弱することが示された。
Federici S, et al:Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell;2022. 185(16):2879-98.e24.
炎症性腸疾患(IBD)は再燃寛解を繰り返す慢性疾患であり,現在治療標的の中心となっている腸管免疫のほかに,遺伝的素因,環境因子が複合的に病態形成に関与している。さらに,近年腸内細菌叢の乱れ,いわゆるディスバイオシスが病態に影響を及ぼすことが報告されている。本研究において,地理的に異なる4つのIBDコホート(n =537)において,疾患の増悪と重症度に強く関連している菌として抗菌薬への体制を有するK. pneumoniae株が同定された。さらに,IBD患者由来K. pneumoniae株を大腸炎モデルマウスに移植すると,腸炎が増強することが確認された。本菌を特異的に排除する方法として5つのファージからなるファージカクテルを作製し,大腸炎罹患マウスへの投与により,K. pneumoniae量を効果的に抑制し,腸炎が改善することが明らかになった。さらに健常ボランティアへの胃酸分泌抑制薬の併用下でのファージの経口投与により,安全性とファージの大腸における長期維持が確認され,今後の臨床応用が期待される。
Ichikawa M, et al:Bacteriophage therapy against pathological Klebsiella pneumoniae ameliorates the course of primary sclerosing cholangitis. Nat Commun. 2023;14(1):3261.
PSCの病因は未だに不明であり,内科的に有効な治療法は存在せず,唯一の治療法は肝移植である。本研究において45名のPSC患者の腸内細菌の解析が行われ,K. pneumoniaeとEnterococcus gallinarumの2菌を保菌する患者はPSC病勢が高く,非移植生存率が劣っていることが示された。病原菌に対する治療アプローチとして感受性を有する抗菌薬が候補となるが,長期使用による耐性菌の出現に留意する必要がある。この問題を打破するために,特定の病原菌のみを選択的に殺菌可能であり耐性菌の出現頻度が低いバクテリオファージの作製が試みられた。PSC患者より分離したK. pneumoniaeを特異的に排除するバクテリオファージカクテルの作製に成功し,その投与によりK. pneumoniae量が低下し,Th17免疫応答を介した胆管障害が減弱することが初めて示された。本成果は,PSCの病態に寄与する腸内細菌を明らかにし,今後腸内細菌を標的としたファージ治療による臨床応用に発展することが期待される。
腸内細菌と原発性硬化性胆管炎
原発性硬化性胆管炎(Primary sclerosing cholangitis:PSC)は,肝内外の胆管に多発性・不連続性の狭窄が発生し胆汁うっ滞をきたす原因不明の慢性炎症性疾患であり,国の指定難病である。2018年に厚生労働省「難治性の肝・胆道疾患に関する調査研究」班が行った全国疫学調査によると,日本における推定患者数は約2,300人,人口10万人あたりの有病率は1.80であり,2007年の全国疫学調査の有病率と比較して約2倍に増加している。潰瘍性大腸炎やクローン病などの炎症性腸疾患(inflammatory bowel disease:IBD)を高率に合併し,日本では約40%,欧米では60~70%の合併が報告されている。PSC患者に合併するIBD(PSC-IBD)は回腸病変(backwash ileitis)を高率に有し,炎症は右側型が多く,直腸に向かうにつれて軽減し,直腸炎の合併は稀である1)。臨床上高率にIBDを合併することから,PSC病態への腸肝相関の関与が示唆される。さらに,腸内細菌を標的とした抗菌薬内服治療により短期的な臨床マーカーの改善を認めること2)がその根拠の一つである。
ヨーロッパを中心とするPSC患者の大規模コホートにおける腸内細菌叢の解析の結果,PSC患者便中の腸内細菌叢は健常人と比較して有意に多様性が低下しており3),さらにEnterococcus,Streptococcus,Lactobacillus,Fusobacterium,Veillonellaなどの腸内細菌が増加していることが報告された4)。また,胆汁中の細菌のディスバイオシス5)や真菌のディスバイオシス6)がPSCの病態に関与する可能性も示唆されている。一方でこれらの腸内細菌叢組成の変化が病態の根本的な原因なのか,または炎症の結果を反映しているのに過ぎないか,さらに腸内細菌がどのような機序で肝臓の病態に寄与するのかについては不明な点が多い。
PSCとIBDの密接な関連性や両疾患で見られる腸内細菌叢の異常から,腸内細菌が自己抗原に似たペプチドの起源である可能性も示唆されている7)8)。興味深いことに,腸内で微生物抗原により活性化されたT細胞が肝臓に移行し免疫損傷を引き起こす腸肝軸(gut-liver axis)を介した機序も提唱されている9)10)。T細胞が肝臓に遊走する機序の一つとして,腸内細菌や炎症性腸上皮から分泌される物質が局所炎症を引き起こし,血管接着タンパク質1(VAP-1)の活性化を介して腸で活性化されたT細胞が肝臓に動員される11)12)。さらに,肝臓に浸潤するT細胞の15~16%が腸のT細胞と同じ受容体を持ち,同じ抗原に応答する能力があることが示されている13)。これらの知見は,PSCの病態形成における腸と肝臓の密接な関連性を示唆している。
さらに,PSC患者由来便の無菌マウスへの糞便移植により,肝臓Th17誘導を介してPSC様硬化性胆管炎を誘発するという筆者らのグループの研究結果は,特定の腸内細菌叢が疾患の発症に直接関与していることを示唆している14)。注目すべきことに,マウス腸間膜リンパ節から検出されたbacterial translocation(腸内に生息する生菌が腸管上皮を通過して腸管以外の臓器に移行する現象)能を有するK. pneumoniaeおよびE. gallinarumはPSC患者便に高率に検出され,海外のコホートでも同様の結果が示された(図1)。さらに,両菌を保菌したPSC患者は非保菌患者と比較して疾患活動性が高く非移植生存率が劣ることが日本,およびノルウェーのコホートで検証され14)~16),PSCの診断バイオマーカーおよび治療標的としての臨床応用が期待される。
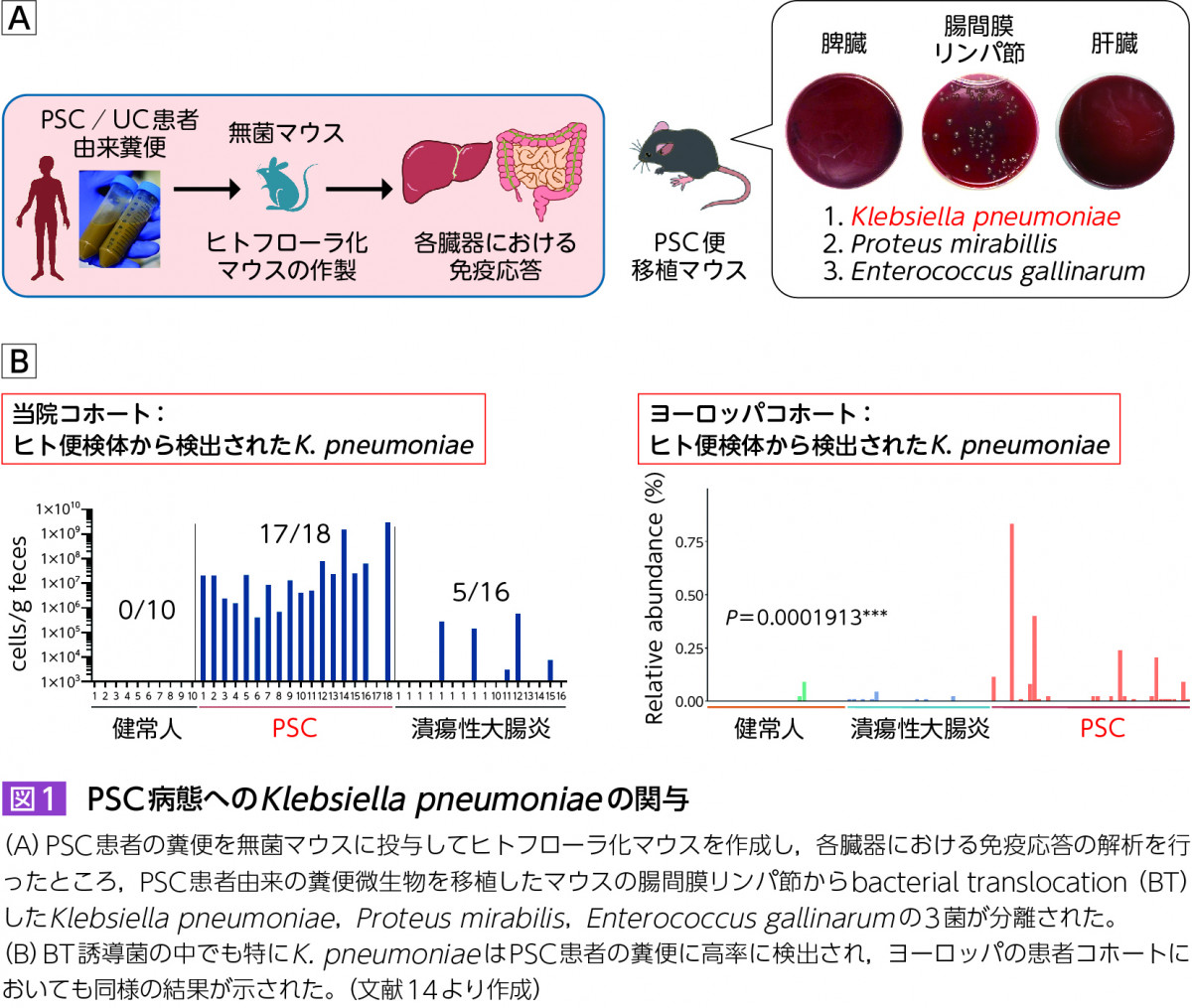
近年の解析技術などの進歩によりPSCをはじめとする肝疾患における腸内細菌研究の進歩は目覚ましいが,病態形成,進展機序の詳細は未だ不明な点が多く,今後のさらなる研究の進展が待たれる。
腸内細菌を標的とした治療応用の可能性
現在腸内細菌の構成異常の改善を目指す治療法として,プロバイオティクス,プレバイオティクス,シンバイオティクス,糞便微生物移植 (fecal microbiota transplantation: FMT),抗菌薬治療,バクテリオファージなど様々な方法が提唱されている(表1)。
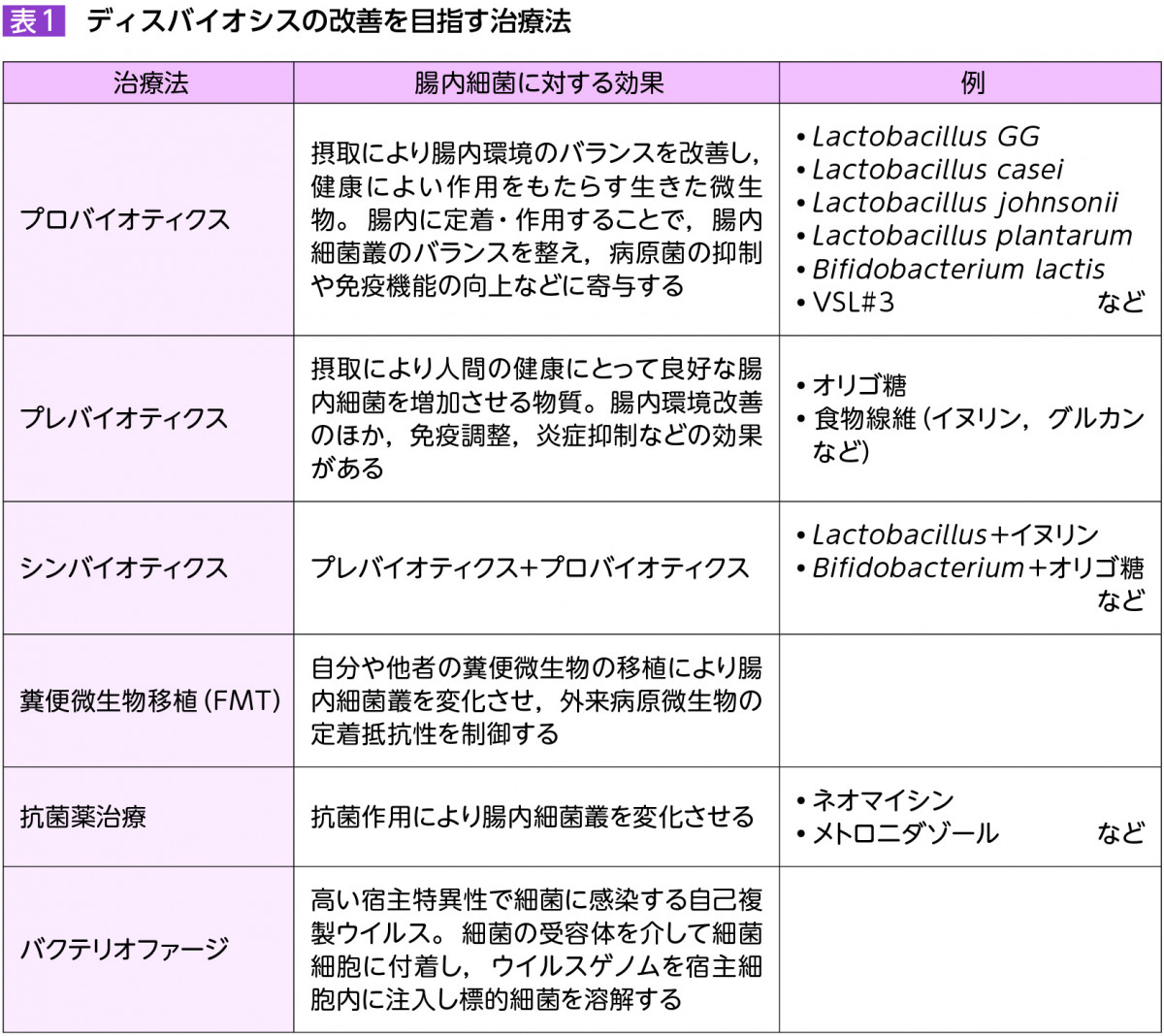
プロバイオティクスは炎症の抑制や恒常性の維持に寄与する微生物自体を示す。腸内細菌のバランスを整えるだけでなく,粘膜バリアの増強,抗菌作用,免疫調整作用などの機序を介して宿主の健康増進に寄与する。プレバイオティクスは消化管に共生する有益な細菌の選択的な栄養源としてその増殖を促進し,ヒトの健康増進に役立つ食品である。またプロバイオティクス,プレバイオティクスの両者を合わせたものがシンバイオティクスである。脂肪肝患者に対するプロバイオティクスおよびシンバイオティクスの有効性が報告されている17)。さらに,肝性脳症やPSCにおける限定的な有効性を示す報告もあり18)19),今後大規模臨床試験における検証が望まれる。
FMTは健常人の腸内細菌を患者の消化管内へ移植することでディスバイオシスの改善を期待する治療である。難治性Clostridioides difficileに対する既存のバンコマイシンと比較した優越性の報告をきっかけに着目されるようになり20),これまでに脂肪性肝炎や肝性脳症をはじめとする肝疾患における有効性が報告されている21)22)。PSCにおいても10例と少数例であるが,FMT投与群で腸内細菌の多様性が増加し,その効果が24週持続したことが報告されている23)。
抗菌薬治療としては,メトロニダゾールやバンコマイシンなどの抗菌薬内服治療の前向き臨床試験が海外で行われており,血清ALP値の有意な低下が示されている2)24)25)。一方で,長期投与による副作用として,ディスバイオシスの助長や長期使用に伴う耐性菌の出現が問題となっている。
近年,特定の病原細菌のみを殺菌するバクテリオファージによる治療が再度脚光を浴びている。バクテリオファージはその特異性から他の腸内細菌叢にほぼ影響を及ぼさないため,腸内細菌叢の変化を最小限に抑え耐性菌の出現を抑制し,安全に使用できることが期待される。肝疾患モデルマウスにおいて,アルコール性肝炎に関与するE. faecalisを標的としたバクテリオファージによる肝炎の改善26)や,MASLDの病態に関するアルコール産生K. pneumoniaeを標的としたバクテリオファージ投与による肝炎の改善27)が報告されている。また,冒頭で紹介したとおり,炎症性腸疾患におけるK. pneumoniaeを標的としたバクテリオファージを用いた有効性が報告され,今後の臨床応用が期待されている28)。
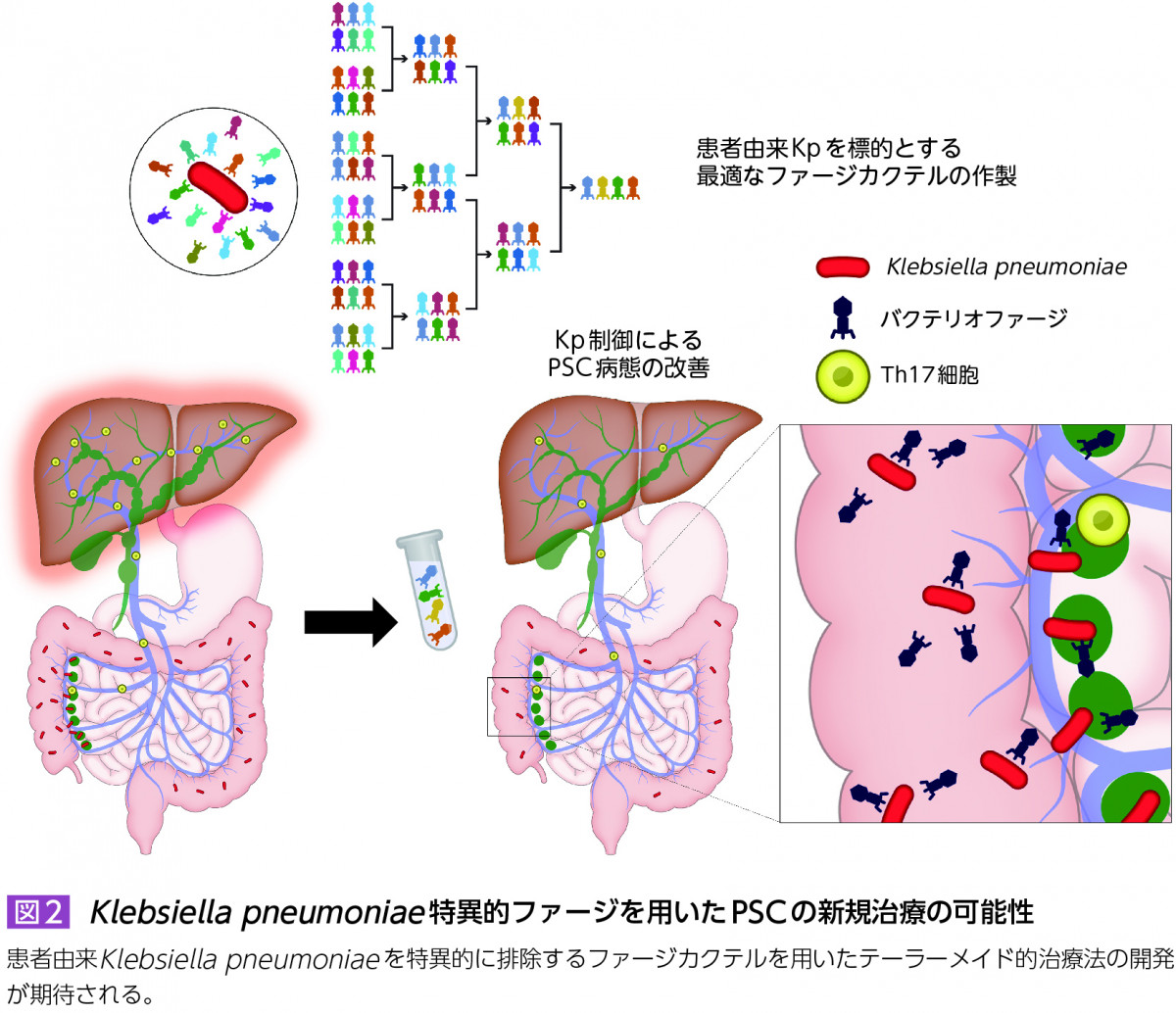
筆者らのグループはPSCにおける患者より分離したK. pneumoniaeを標的としたバクテリオファージの開発を進めており,胆管障害モデルマウスにおけるファージカクテルの有効性と治療応用の可能性を報告した16)。ファージの最適な投与経路や投与回数,安全性など臨床応用に向けて明らかにすべき課題は少なくないが,有効な治療法が存在しない本疾患に対する患者由来K. pneumoniaeを特異的に排除するファージカクテルを用いたテーラーメイド的治療法の開発が期待される(図2)。
まとめ
PSCの発症や進展には,遺伝的要因,胆汁酸代謝,免疫応答の異常など多要因が複雑に関与している。本稿で述べたとおり,腸管バリアの破綻や腸内細菌叢の異常が,腸肝相関を介してPSCの発症や病態進展において重要な役割を果たすことが明らかになりつつある。今後,本分野における腸内細菌研究がさらに進み,腸肝軸を介した詳細な病態進展メカニズムが明らかになり,診断技術や治療標的として臨床応用されることが期待される。
【文献】
1)Jørgensen KK, et al:Inflammatory bowel disease in patients with primary sclerosing cholangitis:clinical characterization in liver transplanted and nontransplanted patients. Inflamm Bowel Dis. 2012;18(3):536-45.
2)Tabibian JH, et al:Randomised clinical trial: vancomycin or metronidazole in patients with primary sclerosing cholangitis - a pilot study. Aliment Pharmacol Ther. 2013;37(6):604-12.
3)Kummen M, et al:The gut microbial profile in patients with primary sclerosing cholangitis is distinct from patients with ulcerative colitis without biliary disease and healthy controls. Gut. 2017;66(4):611-9.
4)Sabino J, et al:Primary sclerosing cholangitis is characterised by intestinal dysbiosis independent from IBD. Gut. 2016;65(10):1681-9.
5)Liwinski T, et al:Alterations of the bile microbiome in primary sclerosing cholangitis. Gut. 2020;69(4):665-72.
6)Lemoinne S, et al:Fungi participate in the dysbiosis of gut microbiota in patients with primary sclerosing cholangitis. Gut. 2020;69(1):92-102.
7)Jendrek ST, et al:Anti-GP2 IgA autoantibodies are associated with poor survival and cholangiocarcinoma in primary sclerosing cholangitis. Gut. 2017;66(1):137-44.
8)Terjung B, et al:p-ANCAs in autoimmune liver disorders recognise human beta-tubulin isotype 5 and cross-react with microbial protein FtsZ. Gut. 2010;59(6):808-16.
9)Grant AJ, et al:Homing of mucosal lymphocytes to the liver in the pathogenesis of hepatic complications of inflammatory bowel disease. Lancet. 2002;359(9301):150-7.
10)Eickmeier I, et al:Influence of CD8 T cell priming in liver and gut on the enterohepatic circulation. J Hepatol. 2014;60(6):1143-50.
11)Liaskou E, et al:Monocyte subsets in human liver disease show distinct phenotypic and functional characteristics. Hepatology. 2013;57(1):385-98.
12)Trivedi PJ, et al:Vascular adhesion protein-1 is elevated in primary sclerosing cholangitis, is predictive of clinical outcome and facilitates recruitment of gut-tropic lymphocytes to liver in a substrate-dependent manner. Gut. 2018;67(6):1135-45.
13)Henriksen EK, et al:Gut and liver T-cells of common clonal origin in primary sclerosing cholangitis-inflammatory bowel disease. J Hepatol. 2017;66(1):116-22.
14)Nakamoto N, et al:Gut pathobionts underlie intestinal barrier dysfunction and liver T helper 17 cell immune response in primary sclerosing cholangitis. Nat Microbiol. 2019;4(3):492-503.
15)Hole MJ, et al:A shared mucosal gut microbiota signature in primary sclerosing cholangitis before and after liver transplantation. Hepatology. 2023;77(3):715-28.
16)Ichikawa M, et al:Bacteriophage therapy against pathological Klebsiella pneumoniae ameliorates the course of primary sclerosing cholangitis. Nat Commun. 2023;14(1):3261.
17)Liu L, et al:Efficacy of Probiotics and Synbiotics in Patients with Nonalcoholic Fatty Liver Disease: A Meta-Analysis. Dig Dis Sci. 2019;64(12):3402-12.
18)Dalal R, et al:Probiotics for people with hepatic encephalopathy. Cochrane Database Syst Rev. 2017;2(2):CD008716.
19)Vleggaar FP, et al:Probiotics in primary sclerosing cholangitis: a randomized placebo-controlled crossover pilot study. Eur J Gastroenterol Hepatol. 2008;20(7):688-92.
20)van Nood E, et al:Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med. 2013;368(5):407-15.
21)Craven L, et al:Allogenic Fecal Microbiota Transplantation in Patients With Nonalcoholic Fatty Liver Disease Improves Abnormal Small Intestinal Permeability:A Randomized Control Trial. Am J Gastroenterol. 2020;115(7):1055-65.
22)Bajaj JS, et al:Fecal Microbial Transplant Capsules Are Safe in Hepatic Encephalopathy:A Phase 1, Randomized, Placebo-Controlled Trial. Hepatology. 2019;70(5):1690-703.
23)Allegretti JR, et al:Fecal Microbiota Transplantation in Patients With Primary Sclerosing Cholangitis:A Pilot Clinical Trial. Am J Gastroenterol. 2019;114(7):1071-9.
24)Färkkilä M, et al:Metronidazole and ursodeoxycholic acid for primary sclerosing cholangitis: a randomized placebo-controlled trial. Hepatology. 2004;40(6):1379-86.
25)Rahimpour S, et al:A Triple Blinded, Randomized, Placebo-Controlled Clinical Trial to Evaluate the Efficacy and Safety of Oral Vancomycin in Primary Sclerosing Cholangitis:a Pilot Study. J Gastrointestin Liver Dis. 2016;25(4):457-64.
26)Duan Y, et al:Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease. Nature. 2019;575(7783):505-11.
27)Seth D, et al:Intrahepatic gene expression in human alcoholic hepatitis. J Hepatol. 2006;45(2):306-20.
28)Federici S, et al:Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation. Cell. 2022;185(16):2879-98.e24.

































