お知らせ
対談 ジェネリック医薬品の臨床効果は先発医薬品と同等と言えるのか?〈提供:日本ジェネリック製薬協会〉
武藤正樹 (国際医療福祉大学大学院教授)
桑島 巖 (東京都健康長寿医療センター顧問/J-CLEAR理事長)
登録日: 2017-08-25
最終更新日: 2020-03-23
- コーナー: DATA
- INFORMATION

Q ジェネリック医薬品に臨床試験は実施されているか?
桑島 本日は、「ジェネリック医薬品の臨床効果は先発医薬品と同等と言えるのか?」をテーマに、この分野に造詣の深い武藤先生に質問していきたいと思います。
先発医薬品はいずれも臨床試験において有効性・安全性が確認されて、はじめて臨床使用が可能になるわけですが、ジェネリック医薬品に関して臨床試験は行われているのでしょうか。実施されている場合、その質はどうなのか、この点についてはいかがでしょうか。
A 血中に移行し全身分布する医薬品に関して臨床試験は求められていない
武藤 1980年代前半までは、ジェネリック医薬品も先発医薬品と同様、承認申請にあたっては臨床試験が義務付けられていました。しかし、「有効成分が同じであるジェネリック医薬品が、先発医薬品で実施された臨床試験を重複して行うことは、時間と経費の無駄であり、安価なジェネリック医薬品を早く提供するという趣旨に反する」との考え方に基づき、1984年に米国において、ジェネリック医薬品の簡略承認申請を認めたハッチ・ワックスマン法が成立し、これが世界的なスタンダードとなりました。
以降、ジェネリック医薬品に関しては、溶出試験と、20人ほどの健康成人においてクロスオーバー法で先発医薬品とジェネリック医薬品の常用量を投与し、血中濃度の推移を比較する生物学的同等性試験のデータを添付しての承認申請が可能になりました。すなわち、投与後、血中に移行して全身に分布する医薬品に関しては、臨床試験は行われていません。これはジェネリック医薬品の承認審査に関する全世界共通の考え方です。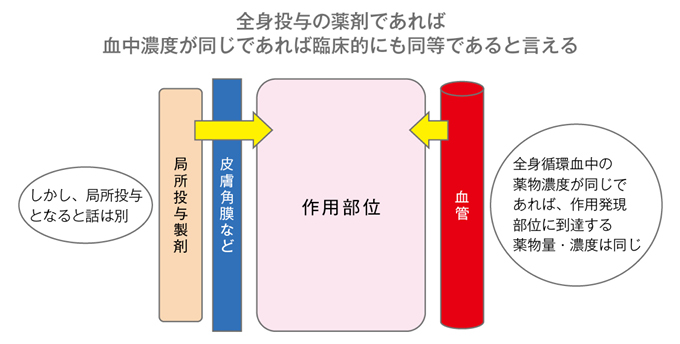
Q 有効成分が同じでも添加物が違えば有効性・安全性は異なるのではないか?
桑島 ジェネリック医薬品の主成分は確かに先発医薬品と同じかもしれませんが、添加物には違いがあります。例えば、認知症治療薬のドネペジル1剤をとっても、含量、剤型、銘柄の別を考えると100ぐらいの種類があり、それぞれで添加物が異なり、場合によっては有害成分が含まれている可能性も否めません。臨床試験は、副作用や有害作用を検出することも1つの目的です。有効成分、添加物を含む1つの薬剤として臨床試験がなされていないという点について、臨床医としての不安があるのが実情なのです。その点ではいかがでしょうか。
A 溶出試験と生物学的同等性試験による同等性の証明方法は先発医薬品で検証済みの方法
武藤 添加物には様々な種類がありますが、先発医薬品もジェネリック医薬品も、使用される添加物に関しては、安全性基準をクリアしたものしか使えないこととされています。ただ、桑島先生がおっしゃるとおり、添加物が異なることによって薬剤の溶出性が変わることがありますので、それに関しては溶出試験を行い、溶出挙動が同じであることの証明が義務付けられています。
この、溶出試験と生物学的同等性試験により同等性を証明する方法は、実際のところ、先発医薬品の製造承認において長年に渡り、検証されてきた方法です。
先発医薬品は販売されて以降、さまざまな製剤的改良が加えられるなかで、添加物や原薬が変更されています。たとえば通常の錠剤がOD錠に剤型変更される場合などがそれにあたりますが、20年、30年と臨床使用されている薬剤の場合、新発売承認時の先発医薬品と、現在使用されている先発医薬品では、添加物などが異なっているケースが少なくありません。しかし、添加物を変更するごとに患者さんを対象とした臨床試験が行われているわけではなく、新しい剤型の承認申請時には、ジェネリック医薬品と同様のガイドラインに基づいて、溶出試験と生物学的同等性試験が行われているのです。剤型と添加物は異なるが有効成分が同一という点において、添加物が変更されて使用されている先発医薬品ではジェネリック医薬品と同様、承認過程を簡略化して製造承認を取得しています。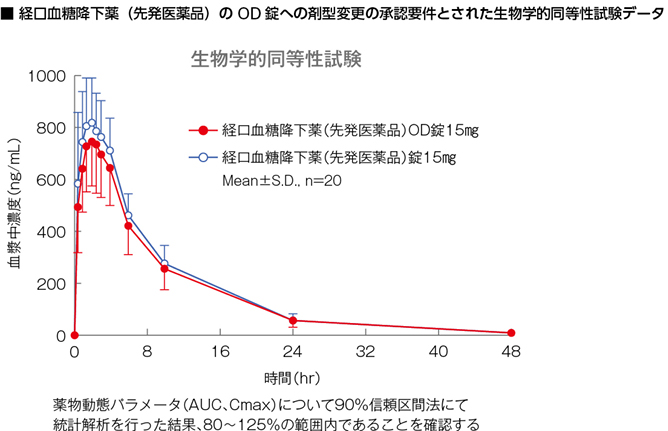
Q ジェネリック医薬品メーカーの数は多く各社に品質のバラつきがあるのではないか?
桑島 ある有効成分の先発医薬品メーカーは1社ですが、ジェネリック医薬品メーカーは全体で20も30もあります。そのうち、ある1社の製品には粗悪な素材が混じっている、といった可能性を除外しきれるかどうかということなのです。抜き打ち的に検査しているのが現状じゃないかと思うのですが、そういう懸念についてはいかがですか。
A すべてのジェネリック医薬品は規格に合致した原薬と添加物を用いて製剤化され、溶出試験、生物学的同等性試験をクリアしている
武藤 原薬の純度や添加物については、販売されているすべての薬剤が、厚生労働省の定める基準をクリアし、その基準内の製品しか使用されていません。
医薬品の製造は非常に国際分業が進んでおり、原薬に関しては先発医薬品メーカー、ジェネリック医薬品メーカーを問わず、海外の原薬メーカーを使っていることが少なくありません。この原薬メーカーに対する不安をどう解消するかは、きちんとした原薬の純度試験が行われ、基準を満たしているか、ということを常に確認するということに尽きるわけです。先発医薬品メーカーも製剤の特許が切れると、安価な原薬を求めて原薬メーカーを変えることも多く、インドの原薬メーカーで原薬を調達し、アルゼンチンの工場で製造し、それを日本で販売しているといったケースも実際にあります。こうした状況に鑑みると、先発医薬品メーカー、ジェネリック医薬品メーカーに関係なく、原薬工場に対する査察というのは非常に重要です。

桑島 先発医薬品メーカーだから安心というわけではないという点はわかりました。しかし、ジェネリック医薬品には多数のメーカーがあるということに対して、まず臨床医としては不安があるのです。その品質が均一かどうかということです。中国や東南アジアなどからいろいろな原薬が導入されるということですが、製造ラインが本当に清潔な環境でなされているのかといったところまで確かな情報がないと、臨床医も患者さんも不安に感じるわけです。その辺りを十分にクリアするだけのエビデンスがあるのでしょうか。例えば100社なら100社全ての製剤について同じような基準でチェックしているわけでしょうか。

武藤 ジェネリック医薬品メーカーは、現在150社程度ありますが、製造工場をもっている会社と販売のみを行っている会社に分かれています。販売会社でみると多いのですが、製造元というのはこれよりはるかに少なく、例えば、現在37社が販売しているアムロジピンの共同開発元を辿ると、10社ほどです。承認申請は製剤ごとに行われ、すべてのジェネリック医薬品は、規格に合致した原薬と添加物を用いて製剤され、溶出試験、生物学的同等性試験をクリアしたものです。
Q ジェネリック医薬品のチェック体制は?
桑島 ジェネリック医薬品を販売する会社が多数あると、価格競争が激化すると考えられますが、そこで出てくる懸念としては、価格に差がつくのはなぜか、どうして安くなるのかという点です。政府として、医療費削減の方針の下で、チェックが少し粗雑になっているんじゃないかという印象は拭えないのです。
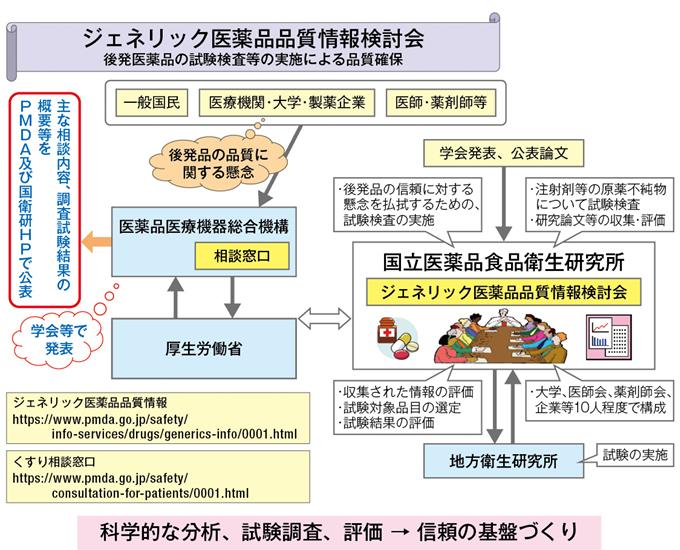
A 市販のジェネリック医薬品の抜き打ち検査や公表臨床文献等の検討を行い、必要に応じて公的機関で溶出試験を実施
武藤 品質を監視するための製品チェックに関しては、市場に出ている医薬品(先発医薬品、ジェネリック医薬品を含む)を対象とした一斉監視指導を、厚生労働省が都道府県の協力を得て実施しています。これは、製品を実際に収去して行う、いわゆる抜き打ち検査です。これに加え、国立医薬品食品衛生研究所に「ジェネリック医薬品品質情報検討会」が設置され、ここではジェネリック医薬品の問題を指摘した公表論文や学会発表を収集し、その検討を行うとともに、その結果必要と判断される場合に溶出試験などを行い品質の確認を行っています。この検討会は、これまで年2回、合計17回開催され(平成28年10月現在)、確認が行われた品目数は1,000品目を超えています。その中で最近、学会において問題ありとされた情報のなかに、溶出状態が先発医薬品に比べて劣っている製品が1つあり、これについてメーカーが再試験を実施し、自主回収の対象になりました。
こうした取り組みのなかで、ジェネリック医薬品メーカーから、どうみても先発医薬品のロット間で溶出挙動に違いがあるのではという訴えがあり、先発医薬品メーカーに申し入れて検査すると、確かにロット間差があったということもありました。医薬品はすべて工業製品ですから、こうしたことは起こり得ますので、先発医薬品・ジェネリック医薬品に限らず、そういうチェックというのは極めて厳重にやるべきであり、それが有効だと思います。
桑島 そうした厳重なチェック体制について、もっと一般の臨床医の間に広めることが非常に大事だと思います。現実には、例えば患者さんにジェネリック医薬品に変えた途端に皮疹が出たとか、胃がむかつくとか、そういうようなことがあるわけです。それはひょっとしたらメンタルな面かもしれませんが。
Q オーソライズドジェネリック(AG)医薬品は先発医薬品と同等か?
武藤 先発医薬品メーカーが製造しているオーソライズドジェネリック(AG)に関してはどのように評価されますか? ガイドラインで推奨することも可能だとお考えですか?
桑島 AGは成分も添加物も先発医薬品と同じであるわけですから、問題ないと思っています。私は基本的には、ジェネリック医薬品はAGの方向にもっていった方がいいと考えており、その理由は、2つあります。1つは、特許切れと同時にジェネリック医薬品に置き換わってしまうということになると、先発医薬品メーカーが経営的に疲弊しまうこと。もう1つは、添加物も成分も全く同じですよと言える点で、医師も患者さんも安心できるということです。
A 一部のAGは製造承認を受けた時点でジェネリック医薬品と何らかわらない
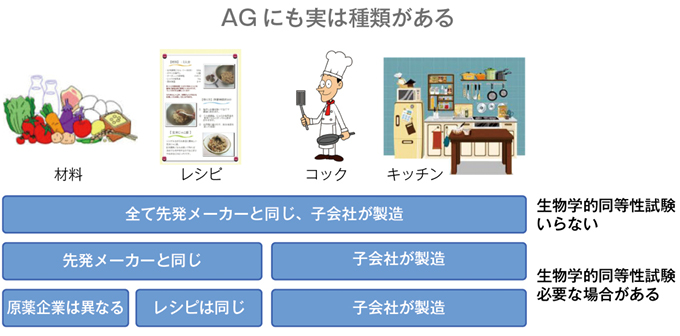
武藤 AGに関してあまり知られていないのは、AGと一括りにされていても、その製造プロセスでいくつかに分けられます。すなわち、すべて先発医薬品メーカーと同じ原薬、製法、技術者、製造ラインを用いて子会社が製造するパターン1(承認申請に際し生物学的同等性試験は不要)に対し、先発医薬品と同じ原薬、製法を用いて子会社が製造するケース(パターン2)や、異なる原薬を用い同じ製法で子会社が製造するケース(パターン3)があり、パターン2,3では生物学的同等性試験が必要です。生物学的同等性試験の結果、先発医薬品とは明らかにAUCやCmaxが異なる場合もあり(ジェネリック医薬品としては承認の範囲内)、AGといっても均一ではありません。
武藤 あるアンジオテンシン受容体拮抗薬のAGは、先発医薬品と同じ原薬、製法を用いて子会社で製造されたのですが、生物学的同等性試験の結果は、製造会社が違っただけで血中濃度が先発医薬品と1割程度異なる結果でした。他のジェネリック医薬品でも差は出てきますが、この差は少し大きいと思いました。ただし、差は基準範囲内でしたので、AGとして承認され使用されています。
つまり、多くの場合添加物などが変更されている先発医薬品や、一部のAGは、生物学的同等性試験を受けて承認されたという点で、ジェネリック医薬品と何らかわるものではないということなのです。
医薬品は工業製品である点で同じですので、ジェネリック医薬品に対する厳しい目を先発医薬品の方にも向けていく必要があるということなのです。
ジェネリック医薬品に対する期待と希望
桑島 ジェネリック医薬品の普及は国の政策であり、今も実臨床での使用が急速に増えています。一旦使い出すとやめられないという患者さんも多くいらっしゃるので、伸びていく可能性は非常に強いと思います。また、先生がおっしゃったように、先発医薬品だって注意すべき点はあるということですが、やはりジェネリック医薬品の製造・販売する会社が数多くあり、それをしっかり監視する必要があるというご意見だと思います。その点では私も全く同感です。
ただジェネリック医薬品に関する情報提供は、非常に少ないと思います。例えば、ジェネリック医薬品に切り替えた際の副作用情報などを、率直に臨床医に伝えるということも非常に大事だと思います。もう1つは安定した供給体制です。ジェネリック医薬品メーカーのなかでも小さいメーカーのものを採用すると、ある日突然この会社は潰れましたというようなことが実際起こっているのです。また、大震災などさまざまな事態において、間に合わずに他の製品に変えざるを得ないといった、そういう点で懸念もあります。
武藤 副作用に関しては、「ジェネリック医薬品品質情報検討会」で収集した文献や学会発表で副作用に関するものも情報を公開しています。また、これは今年度(=平成28年度)からスタートするのですが、「ジェネリック医薬品品質情報検討会」の情報を収載するブルーブックが公表されます。もう1つの供給体制に関しては、欠品をどうやって防いでいくかということは大きな課題ですが、平成18年以降は、少なくとも5年間は継続して製造販売することが義務づけられるようになりました。
情報提供では、メーカーのMRさんも大事ですが、患者さんの身近にいる薬剤師さんがより大事です。今ジェネリックのことに関して勉強してそれぞれ採用とか情報提供をやっていただいているのは、やっぱり病院の薬剤師さんですね。たしかにジェネリック医薬品メーカーのMRさんは数少ないし、そのMRさんを増やすのに費用を費やすのならもっと製品を安くしてほしいという声もあります。
桑島 信頼性の担保のために、情報提供という点では一層努力してほしいと思います。ジェネリック医薬品の使用率がどんどん増えるなか、メーカーは工場増設といったことに追われる状況にあると思いますが、臨床医としては、市販後の追跡調査や全例調査などにも少し力を費やしていただきたいという希望があることを申し上げておきたいと思います。




































