お知らせ
バイオシミラーの臨床導入─現場で何が課題になっているのか【まとめてみました】
特許の切れた先発医薬品に対しジェネリック医薬品(後発医薬品)があるように、バイオ医薬品の世界でも特許の切れた先行バイオ医薬品に対しバイオシミラー(バイオ後続品)があり、国内でも2009年から承認、上市されている。先行バイオ医薬品と「同等であるが同一ではない」という性格を持ち、ジェネリックに比べわかりにくいとも指摘されるバイオシミラーに、医療関係者はどう向き合っていけばいいのか。バイオシミラーを積極的に臨床に活用する消化器病の専門医に話を聞いた。
皆保険守るためにBSを積極使用
JR、名鉄、市営地下鉄の5路線が乗り入れる名古屋市金山駅の目の前に、炎症性腸疾患(IBD)の潰瘍性大腸炎、クローン病を専門とする「よこやまIBDクリニック」がある。大学病院や専門病院で多数のIBD患者を診てきた横山正院長が、若年で忙しい患者が多いという疾患の特性を考慮し、名古屋でも屈指の利便性の高い場所に2015年に開設した。
通院する患者は潰瘍性大腸炎が約550人、クローン病が約130人。抗TNFα抗体のインフリキシマブの処方が必要と判断した患者に対し、横山さんは必ず、先行バイオ医薬品の「レミケード」とともに、バイオシミラー(以下、BSと表記)のCT-P13(商品名:インフリキシマブBS点滴静注用「NK」「CTH」)を選択肢として示す。
横山さんがBSを積極的に使用する理由は3つある。1つは、英国留学をしていた経験もあることから、欧州で多く使用され十分なエビデンスも出ているBSを採用し、国際標準の治療を行いたいという思い。1つは、医師である以上、国内での新しいエビデンスづくりに貢献しなければならないという使命感。もう1つは、国民皆保険を守るため、国の経済的な状況も考慮した診療を行いたいという考えだ。

患者の4割が先行品でなくBSを選択
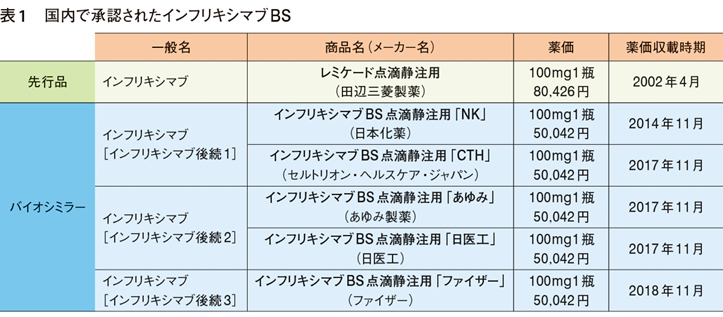
BSの薬価は、「先行バイオ医薬品の薬価から新薬創出加算を除いた額の70%」を基本ルールとして設定される。インフリキシマブBSの場合、100mg 1瓶の薬価は現在、先行品(レミケード)の62%の5万42円と設定されている(表1)。
横山さんは、新規の患者だけでなく、他院で先行品を使用していた継続の患者に対しても、エビデンスや価格差を説明した上でBSの選択肢を示し、患者の判断を尊重する形で処方薬を決めている。現状では4割がBSを選んでいるという。
「先行品からBSにスイッチしても問題ないというデータも海外から出ていますので、継続の患者さんも含めて全員に先行品とBSの選択肢を示しています。4割というのは国内ではかなり高いほうだと思いますが、どんなにエビデンスを説明しても4割にしかならないのが日本の現状です」
大きな価格差があってもBSを選択しない患者が多い背景に、難病の公費負担制度がある。潰瘍性大腸炎もクローン病も医療費助成があり、自己負担の上限(月額)が一般所得者で1~2万円、上位所得者で3万円と決まっているため、先行品を使おうとBSを使おうと窓口負担は変わらないのだ。そのため患者自身に一定の「ボランティア精神」「国の経済的状況への理解」がないと通常BSを選ぶことはない。
横山さんも最初は「海外でデータは出ているとはいえ、どんなものなんだろう」と思いながらBSを使い始めた。しかし実際に使ってみると効果に全く差はなく、安全性に問題があるということもない。「先行品と比べて優れているともいえないし、劣っているともいえないというのが実感ですね」。臨床上特段の問題はないため、いまは自信を持って患者にBSを勧めている。
BSは先行品と「同等/同質」
そもそもBSとはどのようなもので、先行バイオ医薬品とどう違うのか。
日本でBSは「先行バイオ医薬品と同等/同質の品質・安全性・有効性を有する医薬品」と定義されている。化学合成医薬品の世界における先発品に対するジェネリック医薬品の位置づけと似ているが、BSはジェネリックと大きく異なる点がある。
先発品(先行品)との有効成分の比較で、ジェネリックは「同一」であることが求められているのに対し、BSは「同等性/同質性(類似性)」が求められている(表2)。バイオ医薬品は構造が複雑なタンパク質(ホルモン、酵素、抗体など)を有効成分としており、すべての構造が同一のものを製造することはできないため、BSは先行品と同等/同質の有効性・安全性を持っていればよいとされているのである。
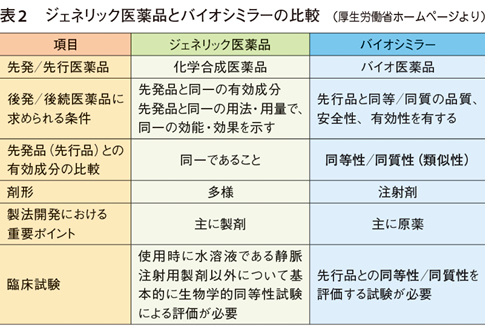
承認申請のための臨床試験で、ジェネリックは生物学的同等性試験のみが必要とされているのに対し、BSは臨床薬物動態(PK)試験、薬力学(PD)試験、PK/PD試験、先行品との有効性の同等性や安全性を検証する試験が求められており、非臨床・臨床を含め多くの試験を行う必要がある。




































