お知らせ
二次性高血圧症
- 登録日:
- 2017-03-16
- 最終更新日:
- 2017-06-14
- 伊藤貞嘉 (東北大学大学院医学系研究科腎・高血圧・内分泌学分野教授)
- 小野美澄 (東北大学東北メディカル・メガバンク機構地域医療支援部門)
■疾患メモ
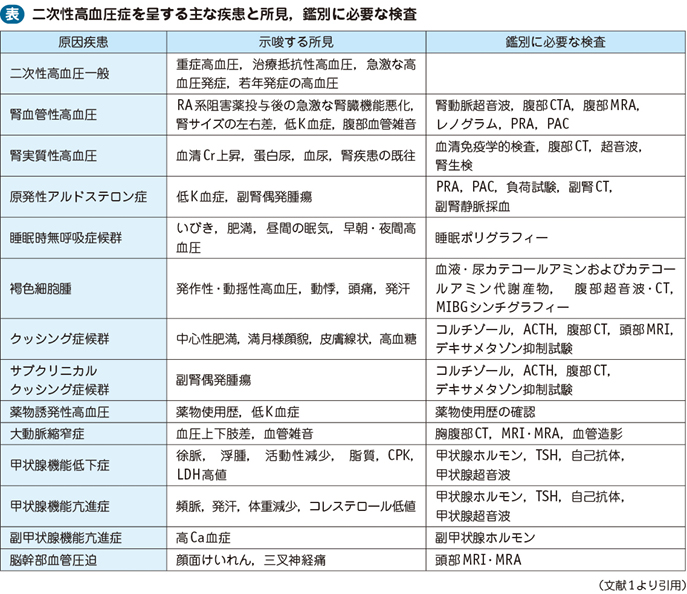
□高血圧患者の約20%を占め,腎実質性高血圧,腎血管性高血圧,原発性アルドステロン症(primary aldosteronism:PA)や傍神経節腫・褐色細胞腫などの内分泌性高血圧,睡眠時無呼吸症候群が代表的である(表)1)。
■代表的症状・検査所見
【症状】
□若年(30歳以下)もしくは高齢になってからの重症高血圧。
□慢性腎臓病(CKD)・蛋白尿・アルブミン尿の存在や腎疾患の既往(腎実質性高血圧,腎血管性高血圧疑い)。
□多飲・多尿・夜間尿の有無(腎実質性高血圧,PA,クッシング症候群疑い)。
□四肢脱力,周期性四肢麻痺の有無(PA,クッシング症候群,甲状腺機能亢進症疑い)。
□中心性肥満,満月様顔貌,野牛様肩,赤色皮膚線条,皮膚の非薄化,挫瘡,多毛,爪白癬の有無(クッシング症候群疑い)。
□発作性の頭痛や動悸,発汗の有無(傍神経節腫・褐色細胞腫疑い)。
□体重減少の有無(傍神経節腫・褐色細胞腫・甲状腺機能亢進症疑い)。
□睡眠時のいびき,無呼吸,夜間中途覚醒,熟眠感の欠如,日中の異常な眠気(睡眠時無呼吸症候群疑い)。
【検査所見】
〈腎実質性高血圧〉
□原因として慢性糸球体腎炎(顕性蛋白尿・血尿),多発性嚢胞腎(超音波断層像・CTで嚢胞を確認),糖尿病性腎症(糖尿病の既往,慢性糸球体腎炎などを除外)などがあり,CKDを伴うことが多い。
□高血圧に先行して検尿異常や腎機能障害が存在する,妊娠早期からの高血圧や蛋白尿が存在すればCKDに伴う高血圧である可能性が高い。
□本態性高血圧症に伴う腎硬化症では尿沈渣所見に乏しく,蛋白尿は軽度である。
□高齢者では,アテローム動脈硬化性の腎血管性高血圧や虚血性腎症との鑑別も必要である。
□腎機能障害が軽度の場合は,腎生検による組織診断の施行も検討する。
〈腎血管性高血圧〉
□腎動脈の狭窄により腎臓からのレニン分泌が過剰となり,レニン─アンジオテンシン─アルドステロン系が亢進し高血圧となる。30歳以下もしくは55歳以上で重症高血圧を発症することが多く,その原因として粥状硬化性腎動脈狭窄(atherosclerotic renal artery stenosis:ARAS)が最も多く,若年者では線維筋性異形成(fibromuscular dysplasia:FMD)も多い。
□腹部血管雑音を聴取可能な症例も多く,典型的には血漿レニン活性(plasma renin activity:PRA)高値,高アルドステロン血症,低カリウム血症を呈する。
□両側性の腎動脈狭窄ではPRAは上昇せず,腎血管性高血圧患者の20%でPRAが正常である。
□腎動脈超音波や血管造影CT(CTA)・磁気共鳴血管造影(MRA)で腎動脈狭窄の存在を確認(ただし腎機能低下症例の場合,慎重な造影剤の適応が求められる)。
□PRA検査やカプトプリル負荷レノグラムは薬剤による影響が大きく,画像診断を中心とする形態学的診断を施行した上で,補助的診断として有用である。
〈PA〉
□副腎からアルドステロン自律分泌により高血圧となり,高血圧患者の約5~10%がPAとされる。中でも治療抵抗性高血圧患者で約20%を占める。
□副腎腫瘍手術によって治癒が期待できるアルドステロン産生腺腫(aldosterone producing adenoma:APA)両側副腎皮質過形成の特発性アルドステロン症(idiopathic hyperaldosteronism:IHA)の2つに大きく分類される。
□典型例では低カリウム血症,血漿アルドステロン(PAC:単位ng/dL)高値(PAC>12),PRA低値,PAC/PRA比(ARR)>20(PACの単位がpg/mLの場合はARR>200)を呈するが,比較的軽症の例では低カリウム血症を呈さないことがある。
□ACE阻害薬,ARB,・直接レニン阻害薬,β遮断薬,アルドステロン拮抗薬,利尿薬などの降圧薬は偽陽性・偽陰性の原因となるため,少なくとも2週間(アルドステロン拮抗薬は最低6週間以上)の休薬をし,カルシウム拮抗薬やα遮断薬,ヒドララジンでの血圧管理が求められるため,検査のリスク&ベネフィットに十分な考慮が必要である。
□なるべく午前中の早い時間帯に15~30分間坐位もしくは臥位で安静の後に採血することが求められる。
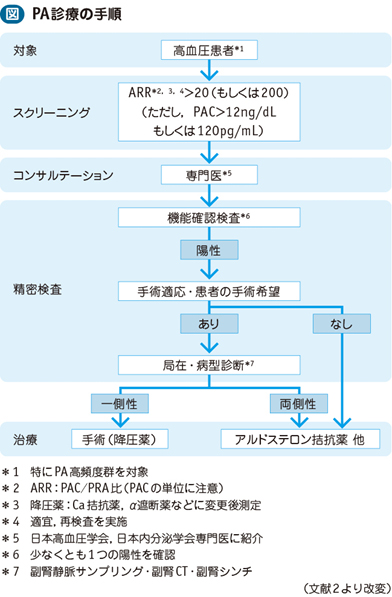
□スクリーニング検査で陽性の場合,専門医に紹介することが望まれる。
□機能確認検査としてカプトプリル負荷試験(カプトプリル50mg経口負荷後60分,または90分ARR>20),フロセミド立位負荷試験(フロセミド40mg静注2時間立位負荷後PRA<2.0ng/mL/hr),生理食塩水負荷試験(2Lを4時間で負荷後のPAC>6.0ng/dL)の少なくとも1種類の陽性を確認すればPAの確定診断となる。
□上記スクリーニングおよび機能確認検査は,低カリウム血症が存在する場合,低カリウム血症によるPAC過小評価を避けるために経口カリウム製剤で補正してから行う。
□フロセミド立位負荷試験は身体的負担が大きく,生理食塩水負荷試験は検査時間が長く,心・腎機能低下症例では推奨されない。
□機能確認検査陽性症例で手術療法を希望する場合は,局在診断が必要である。
□CTで副腎腫瘍の検索を行うが,腫瘍が存在しても非機能性である可能性があり,一方でCTでは検索不可能な5mm以下の微小APAも報告されている。
□患者本人が手術療法を希望する場合,局在診断のために副腎静脈サンプリング(adrenal venous sampling:AVS)を行う。
□AVSは比較的侵襲性の高い検査であり,右副腎静脈へのカニュレーション成功率の問題もあり,実施可能施設が限られているのが現状である。
□近年では,マイクロカテーテルを使用した副腎内での分支採血(segmental AVS)により,左右だけでなく同側副腎内でのAPA局在診断もある程度可能となってきている。
□アドステロールシンチグラフィーは感度・特異度が低く,本検査のみでの局在診断は推奨されない。
□PA診療の手順の流れを図2)に示す。
〈クッシング症候群〉
□副腎皮質刺激ホルモン(adrenocorticotropic hormone)ACTH非依存性もしくはACTH依存性にコルチゾールが自律的に過剰分泌されることにより高血圧,糖尿病,易感染性,クッシング徴候を呈する。
□好酸球減少,低カリウム血症,高血糖,脂質異常症,骨粗鬆症を呈する。
□血中コルチゾール高値と日内変動消失,尿中遊離コルチゾール増加,デキサメサゾン抑制試験でコルチゾールの抑制不十分(夜間デキサメサゾン1mg内服後翌朝コルチゾール>3μg/dL)を確認する。
□血中ACTHやcorticotropin-releasing hormone(CRH)負荷試験でACTH依存性,非依存性を確認し,腹部CTや下垂体MRIで副腎病変,下垂体病変を確認する。
□クッシング徴候を呈さないサブクリニカルクッシング症候群に注意する。
〈傍神経節腫・褐色細胞腫〉
□副腎髄質もしくは傍神経節由来のカテコラミン分泌腫瘍による高血圧(副腎髄質由来の腫瘍を特に褐色細胞腫と呼ぶ)。
□血中カテコラミン,24時間蓄尿カテコラミンやカテコラミン代謝産物であるメタネフリン・ノルメタネフリン排泄量の増加を認める。
□腹部CTで腫瘍の局在を確認するが造影剤使用は原則禁忌であり,やむをえず施行する場合はあらかじめドキサゾシンなどの経口α遮断薬を十分量投与する。あるいはフェントラミンやプロプラノロール,もしくはランジオロールなどの経静脈的投与可能なα・β遮断薬を用意しておく必要がある。
□MRIではT1強調像で低信号,T2強調像で高信号を呈するのが典型的である。
□123I-MIBGシンチグラフィーや18F-FDG-PET/CTは局在診断に有効である。
〈睡眠時無呼吸症候群〉
□夜間睡眠中に吸気時の上気道虚脱による気流停止から周期的な低酸素血症を繰り返し,心・脳血管障害のリスク要因となり,二次性高血圧の中で最も多い要因となっている。
□簡易アプノモニターによるスクリーニングを行い,無呼吸・低呼吸指数(apnea hypopnea index:ALI)5以上,ないしは酸素飽和度低下指数(oxygen desaturation index:ODI)10以上の場合,積極的に専門家に紹介し,ポリソムノグラフィー(polysomnography:PSG)による精査を行う。
1190疾患を網羅した最新版
1252専門家による 私の治療 2021-22年度版 好評発売中
PDF版(本体7,000円+税)の詳細・ご購入は
➡コチラより





























